탄산수에는 이산화탄소가 얼마나 들어 있을까?
이전 실험에서 풍선불기에 실패한 적이 있다. 왜 실패 했는지 알기 위해서는 구입한 탄산수 안에 이산화탄소양이 얼마나 들어 있는지 알아낸 후, 탄산수에 있는 이산화탄소가 모두 빠져나왔을 부피가 얼마나 증가하는지 알아보면, 풍선을 불 수 있는지 알 수 있을 것이다.
그래서 탄산수 내부에 이산화탄소가 얼마나 들어있는지 알아보기로 했다. 이건 기체용해도와 관련이 있다.
(인터넷 검색을 해 봤지만, 정확하게 나와 있는 곳이 없어서 시간이 많이 걸렸다.)
헨리의 법칙에 의하면 부분압을 고려한 기체의 용해도 식은
P=K × S 가 된다.
이때
P는 기체 분압(atm)
K 는 25도일 때 물에 대한 이산화탄소 헨리상수 29.76 atm/(mol/L)
S 는 리터당 몰 용해도(mol/L)
탄산수 1L 내부 압력이 3기압이라고 하면
P = K × S
3기압=29.76 × S
S=0.1008M
3기압에 녹아 있는 이산화탄소의 양은 0.1008mol 이 된다.
이산화탄소 1mol 이 44g 이므로 0.1008mol × 44g/mol = 4.43g의 이산화탄소가 녹아 있다는 것을 알 수 있다.
따라서 물 1L에 25도 3기압에 녹아있는 이산화탄소 양은 4.43g
이산화탄소 몰수는 0.1008 mol 이므로
모두 기체로 바뀌었을 때 이산화탄소 부피는 2.258L 가 된다. (0.1008mol × 22.4L)
(0도가 아니라 25도 이기 때문에 샤를의 법칙에 의해 부피는 298/273 만큼 증가하겠지만 일단은 무시하기로 한다. )
헨리의 법칙에 의하면 기압과 용해도는 비례하므로
물 1L에 녹아있는 이산화탄소 양은 1기압이 증가할때 마다
1.48g (약 1.5g)씩 더 녹아 들어간다는 것을 알 수 있다.

이산화탄소 몰수로는 0.0336mol, 이산화탄소 부피로는 0.75L 이다.
3기압 탄산수 1L를 흔들어 이산화탄소가 모두 빠져 나오면, 탄산수에서 빠져나온 이산화탄소 부피는 약 2.25L라는 걸 알 수 있다.
그런데 탄산수 입구에 풍선을 씌워서 흔들면 빠져나온 이산화탄소를 이용해 풍선을 부풀게 할 수 있는데, 일반적으로 풍선을 불 수 있는 압력이 약 1.02기압 정도이기 때문에, 위 그래프에서 2기압차이 만큼만 이산화탄소가 빠져 나온다. 약 1.5L 부피만큼 이산화탄소가 빠져나온다는 거 .
풍선의 부피가 1.5L가 되면 풍선의 반지름은 얼마나 될까? 구 부피를 계산하는 공식에 넣어 보면 금방 알 수 있다. 부피는 반지름의 세제곱에 비례하므로

계산해 보면 풍선의 부피가 1.5L 일때 풍선의 반지름은 약 7.1cm(지름 14.2cm) 정도 된다.
탄산수 3기압에서 1기압으로 감소시켰을 때(2기압 차이) 용해도 차이로 빠져 나올 수 있는 이산화탄소 기체의 최대 부피(풍선 부피)와 풍선 지름과의 관계를 계산해 놓았다. 아래표는 2기압 차이가 날때 빠져나온 이산화탄소 양을 계산해 논 표이다.
(실제는 3기압 차이만큼 이산화탄소가 빠져 나와야 한다. 왜냐하면 공기중에 이산화탄서 기체분압은 거의 0기압에 가깝기 때문이다. 아래 표는 다시 수정해서 올려놀 예정임)
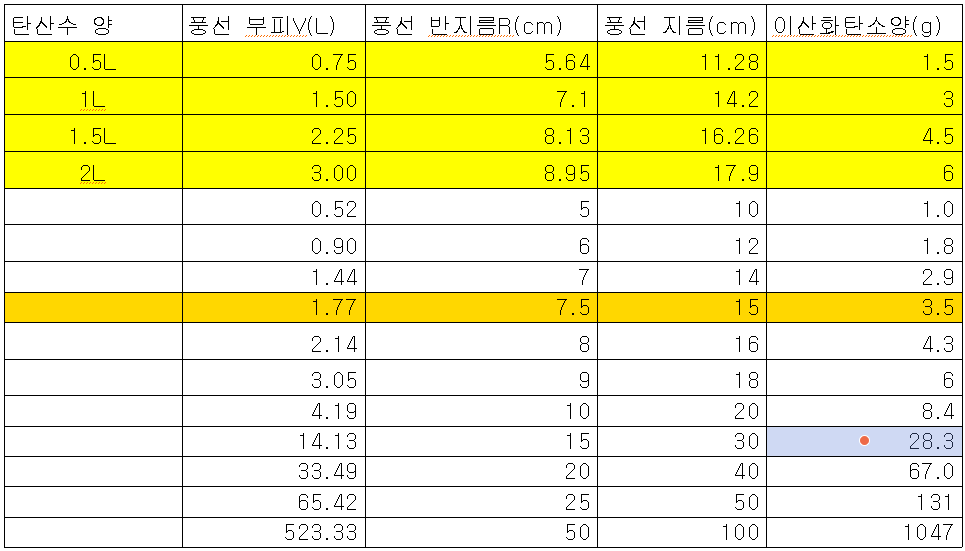
2L 탄산수를 사용했다면 풍선의 부피는 3L가 되고 풍선의 반지름은 8.95cm(지름 17.9cm) 정도가 된다. 마찬가지로 1.5L 페트병은 풍선 부피 2.25L 풍선 반지름 8.13cm(지름 16.26cm)가 된다.
그런데 우리가 사용하는 탄산수는 0.5L(500ml) 짜리를 사용하므로 1L의 절반만큼만 이산화탄소가 빠져 나왔다고 봐야 한다. 3기압에서 1기압이 되었다면 빠져나온 이산화탄소 부피는 약 0.75L 빠져나올 것이고, 풍선의 반지름은 약 5.64cm(지름 11.28cm) 정도 커지게 만들 수 있을 것이다.
이제 탄산수를 흔들어서 풍선을 터뜨리지 못한 이유를 알 수 있다.
방금 구입한 500mL 탄산수 내부기압이 약 3기압이라고 가정하고 탄산수 뚜껑을 열고 풍선을 씌워서 열심히 흔들었을 때, 탄산수에 녹아있던 이산화탄소가 다 빠져나와 1기압이 되었다고 가정하면 입구에 덮어씌운 풍선의 크기는 지름 11.28cm가 된다. 이 크기로는 풍선이 터지지 않는다.
하지만 풍선조각으로 씌워 놓았던 경우에는 풍선조각이 부풀어 오르다가 결국 터진 것을 볼 수 있었다.
탄산수 흔들어서 풍선 불기 [탄산수 실험3]
풍선은 1기압 보다 약간만 커져도 불 수 있다. 예전에 풍선을 불 때 내부기압이 어떻게 변하는지 했던 실험이 있다. https://sciencelove.com/2181 크기가 다른 두 풍선을 연결하면 어떻게 될까?(기압차이
sciencelove.com
실제 이산화탄소는 생각처럼 잘 빠져나오지 않는다. 실험을 해 보면, 탄산수 뚜껑을 열어 놓고 하루가 지나도 탄산수 안에 이산화탄소가 상당히 많이 남아 있는 걸 볼 수 있었다. 심지어는 1주일이 지난 뚜껑을 열어 놓은 탄산수를 따라보면 기포가 올라오는 걸 볼 수 있었다.
따라서 실제 실험의 경우 탄산수를 열심히 흔든다 해도, 이론처럼 1기압까지 바로 이산화탄소 용해도가 감소하지는 않을 것이다.
<추가실험>
1. 500mL 탄산수 뚜껑을 열었다가 바로 닫아 놓으면 오랜 시간이 지나도 탄산이 신선(?)하다. 하지만 절반을 먹고 뚜껑을 닫아 놓은 경우에는 오랜 시간이 지나면 김이 거의 빠진다. 그 이유도 생각해 보았다.
500ml 탄산수 뚜껑을 열었다 바로 닫으면 탄산수 윗 부분에 빈 공간이 많지 않다. 따라서 이산화탄소가 조금만 빠져 나와도 분압이 높아져서 3기압 가까운 곳에서 동적평형이 이루어질 것이다. 그래서 오랫동안 보관해도 김이 빠지지 않은 탄산수를 먹을 수 있다.
하지만 절반쯤 먹은 탄산수의 경우 250mL 의 탄산수가 남아있고, 빈 공간도 250mL 정도 남아 있게 된다. 동적평형이 이루어 지려면 탄산수 내부 기압이 올라가야 하는데, 250mL 탄산수 3기압에서 1기압으로 감소할 때 나올 수 있는 이산화탄소 부피는 375mL 정도 된다. 그럼 탄산수 빈 공간이 250mL 정도 였으니까 그 안에 기체 분압이 이론적으로 1.5기압 정도 된다. 그럼 이산화탄소 용해도가 커져서 1기압일 때 보다 조금 더 녹아 들어갈 것이다. 동적평형이 일어나는 시점을 계산해 보면 약 1.285 기압 정도에서 동적평형이 이루어 진다. 따라서 절반만 먹고 남겨둔 탄산수는 오랜시간(일주일 정도) 지나면 김이 거의 다 빠진다고 봐도 된다.
2. 콜라+멘토스 실험
탄산수를 절반만 남겨 놓고 멘토스를 집어 넣고 뚜껑을 닫으면, 콜라병 안의 압력은 거의 증가하지 않을 것이다. 이론상 1.2기압 정도가 될 것이다.
새로산 탄산수를 열었다 멘토스를 넣고 바로 닫으면 내부 압력은 크게 증가할 것이다. 아니면 3기압을 유지할 것이다?
(나중에 실험해 볼 예정)
3. 탄산수에 녹아있는 이산화탄소 제거하기
따뜻한 물에 탄산수를 담가서 온도를 60도 정도로 올린 다음 무게를 재고, 흔든 다음 뚜겅을 열어 발생한 이산화탄소를 제거한다. 30번 정도 반복해서 최종 무게를 측정하면, 빠져나간 이산화탄소 양을 알 수 있다. 마지막 흔들었을 때 기포가 거의 발생하지 않을 때까지 계속 해야 한다. 높은 온도에서 하면 많은 이산화탄소를 빨리 제거할 수 있다.
아래 동영상을 먼저 보자. 직접 실험해 보았다.
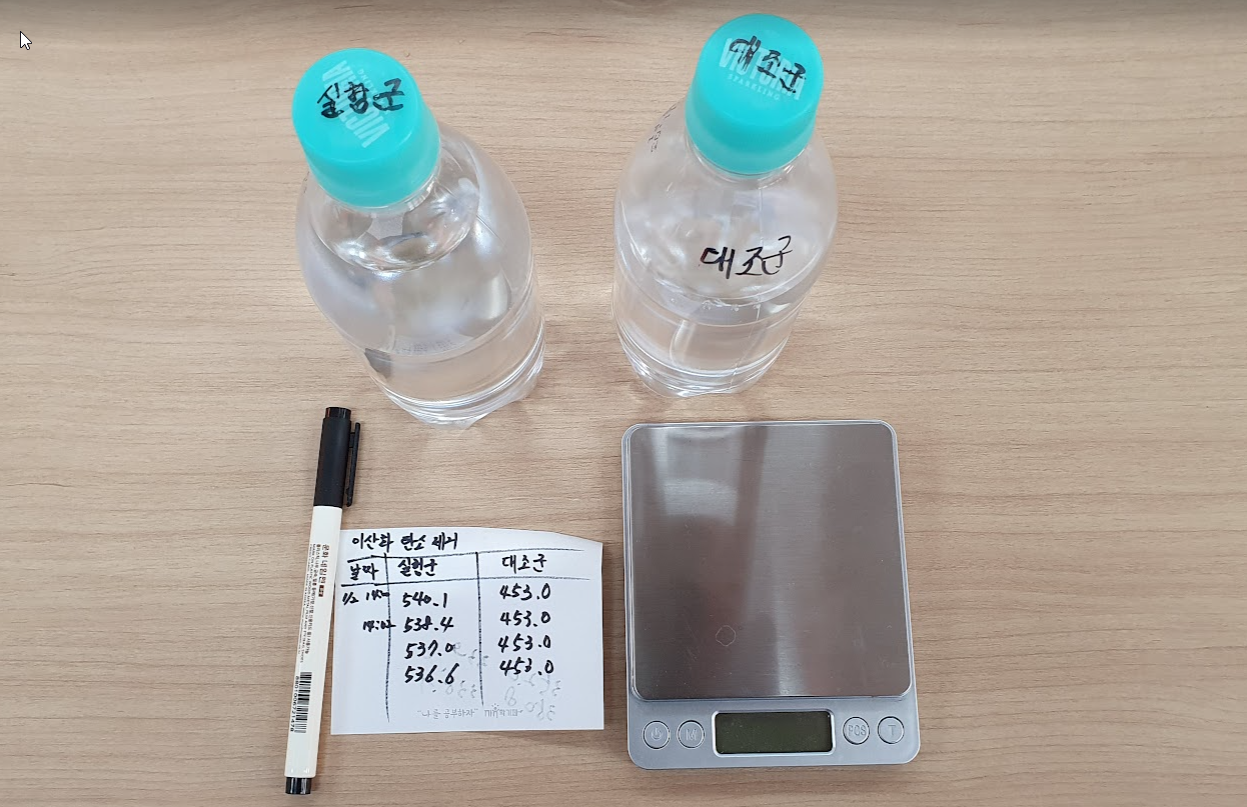
실제 실험해서 처음과 나중 질량 차이를 비교해 보니 약 3.5g 정도 질량이 줄었다.
(대조군은 뚜껑을 닫아 놓은 탄산수병이다. 아침과 저녁 온도에 따라 전자저울 값이 조금씩 달라지는 듯 하여, 대조군으로 변하지 않는 탄산수를 두어 전자저울값을 보정하는데 사용했다. 다행히 실험하는 동안 전자저울 값은 변하지 않았다.)

이론에서는 500mL 탄산수를 3기압 25도에서 1기압으로 60도로 바꾸면 이산화탄소 용해도가 감소해서 2g(1L 라면 4g) 정도 이산화탄소가 빠져나와야 하는데 생각보다 많이 빠져 나온다.
이론적으로는 25도 3기압인 500mL 탄산수에서 빠져나올 수 있는 이산화탄소 질량은 3기압차이 만큼 빠져나오니까 약 2.25g 이 될 것이이다. (2기압 차이가 아니라 3기압 차이인 이유는 뚜껑을 열었을 때는 대기에 이산화탄소가 거의 포함되어 있지 않으므로 대기의 이산화탄소 분압은 거의 0기압과 같다. 따라서 3기압에 녹아있는 이산화탄소가 거의 다 빠져 나올 것이다. 풍선을 부는 실험의 경우에는 빠져나온 이산화탄소가 대기중으로 나가지 못하고, 풍선내부에 가득차기 때문에 풍선안 이산화탄소 분압이 1기압이 될때까지만 빠져나오기 때문에 2기압 차이만큼 빠져 나온다.)
아마 탄산수를 제조할 때 25도가 아니라 더 낮은 온도에서 3기압으로 제조한게 아닐까 추측해 본다.
처음 그래프를 참고하면, 1L 탄산수를 만약 0도에서 3기압으로 제조했다면 처음 녹아있는 이산화탄소 양은 약 10g 이 된다. 우리는 500mL 탄산수를 사용했으므로 5g 정도 질량이 줄어든게 된다. 따라서 탄산수를 25도가 아닌 더 낮은 온도에서 3기압으로 제조했다고 가정하면, 실험결과처럼 약 3.5g 질량이 줄어든 이유가 설명이 된다.
3.5g 이산화탄소가 모두 빠져 나오면 이산화탄소 부피는 1.8L가 되고 그럼 풍선 지름은 약15 cm 가 된다. 하지만 풍선실험의 경우에는 이산화탄소가 모두 빠져나오는게 아니라 2기압 차이만큼 빠져나오기 때문에(풍선내부 이산화탄소 분압이 1기압이기 때문에) 풍선안 기체 온도때문에 조금 더 부풀어 오른걸 고려한다 해도, 동영상 실험 결과와 이론값은 거의 일치한다는 걸 알 수 있다.
탄산수 병에 압력계를 연결하고 병을 흔들었을 때 압력이 올라가지 않으면 이산화탄소가 1기압 용해도 만큼만 남고 거의 다 빠져 나왔다는 걸 알 수 있다.
기압계 달고 같은 실험 반복 이번에는 3.8g 차이가 난다.

<궁금한점>
시중에서 판매되는 탄산수 김이 빠지지 않게 보관하는 압력마개는 효과가 있을지 갑자기 궁금해 졌다. 헨리의 법칙에 의하면 기체의 용해도는 기체분압과 관련이 있다. 그런데 압력마개는 이산화탄소의 압력을 증가시키는게 아니라, 공기의 압력을 증가시키는 장치다. 따라서 탄산수병 안에 압력이 높아졌다 해도, 이산화탄소 분압은 거의 변화가 없을 것이다. 공기중에 포함된 이산화탄소양은 아주 작아서 무시할만 하다.
그렇다면 압력마개는 효과가 있을까?
검증해 보지는 않았지만 혼자 생각해 보면
아마 펌프질을 해서 공기압력을 증가시키는 동안 아주 소량이지만 이산화탄소 분압이 증가했을 것이다. 그리고 또 한가지 생각은 공기의 압력이 증가하면, 동적평형을 이루는데 시간이 더 오래 걸리지 않을까 추측해 본다. 그래서 탄산음료를 김이 빠지지 않게 보관할 수 있다고 말하는 건 아닐까?
실제로 3번을 실험해 봤는데 의미있는 차이를 찾을 수 없었다.

첫번째는 탄산수를 절반만 남기고, 하나는 압력을 넣은채로, 하나는 그냥 뚜겅만 닫은채로 하루동안 놓아 둔 후 질량을 측정해 봤는데 감소한 질량이 0.4g 으로 거의 똑같다.
두번째는 한번 실험이 끝난 탄산수를 가지고 다시 실험해 봤는데, 하루 후에 질량을 측정하니 오히려 압력을 넣지 않은 탄산수가 질량이 0.1g 작게 나왔다. 0.1g 정도는 실험 오차로 볼 수 있다.
마지막으로 압력을 넣은것과 넣지 않은 절반만 남긴 탄산수를 뜨거운 물에 담그고, 힘껏 흔들고 해서 이산화탄소 발생을 일부러 촉진시켰다. 그리고 나서 질량을 측정했는데 차이가 1.1g 으로 똑같았다.
추가실험이 필요하겠지만, 압력마개는 본 실험에서는 큰 의미가 없는 것으로 보인다.
<인터넷에 추가로 실험한 영상이 올라와 있다.> - 김민성샘이 알려 주셨다.
결론은 헨리의 법칙은 동적평형이 이루어지는 건데, 오랜시간이 지나면 압력마개가 별 의미가 없다는 이야기다
하지만 압력을 높여 놓으면 동적평형이 이루어질때 까지 많은 시간이 걸리기 때문에, 단시간에는 효과를 볼 수 있다는 내용이다.
따라서 절반은 맞고, 절반은 틀리다. 조건에 따라 다를 수 있다.
참고로 이산화탄소의 농도를 PH 측정기를 이용하는 것도 재미있다.



